I.
STRUKTUR ATOM
A. TEORI ATOM
1.
Demokritus
Materi
bersifat diskontiniu, bila suatu
mater dibelah hingga tidak dapat dibelah lagi maka bagian yang tidak dapat
dibagi-bagi lagi disebut atom (a=tidak, tomos=terbagi).
2.
Dalton
- Setiap materi terdiri atas partikel terkecil disebut atom;
- Unsur adalah materi yang terdiri atas atom sejenis;
- Atom-atom unsur adalah identik tetapi berbeda dengan atom-atom lain;
- Senyawa adalah materi yang terdiri atas dua jenis atom atau lebih dengan perbandingan tertentu;
- . Reaksi kimia adalah penataan ulang atom-atom. Suatu atom tidak dapat diciptakan atau dimusnahkan.
3. J.J. Thomson
 Atom terdiri atas muatan positif dengan elektron-elektron yang tersebar
di antara muatan-muatan positif, seperti kismis di dalam roti.
Atom terdiri atas muatan positif dengan elektron-elektron yang tersebar
di antara muatan-muatan positif, seperti kismis di dalam roti.
4. Rutherford
Atom
terdiri atas inti atom yang bermuatan positif dan elektron yang beredar
mengitari inti pada jarak yang relatif sangat jauh.
5.
Niels Bohr
Dalam
atom, elektron mengelilingi inti atom pada lintasan atau tingkat energi tertentu. Selama bergerak mengelilingi inti,
elektron tidak menyerap atau melepas energi. Selama elektron berpindah ke
tingkat energi yang kebih tinggi dengan menyerap energi dan pindah ke tingkat
yang lebih rendah dengan memancarkan energi.
6, Teori
Atom Mekanika Kuantum
Dalam
atom terdapat orbital, yaitu daerah di sekitar inti dengan kebolehjadian
menemukan elektron.
a. Menurut de
Broglie, elektron dalam atom bersifat sebagai partikel dan sebagai gekombang.
b. Menurut Werner Heisenberg kecepatan dan posisi
elektron tidak dapat ditentukan secara pasti. Yang dapat ditentukan
adalah
kebolehjadian menemukan elektron pada jarak tertentu dari inti.
c. Menurut
Schrodinger bentuk orbital adalah tertentu berdasarkan persamaan fungsi gelombang.
Ø
Orbital s
Ø Orbital p
Ø Orbital d
Ø Orbital f
B.
Jenis Atom
ü
Atom Netral = tidak bermuatan
|
ü
Atom Kation = bermuatan positif
|
ü
Atom Anion = bermuatan negatif
|
C.
Isotop, Isoton, Isobar dan Isoelektron
Isotop = nomor atom, lambang atom (=)
Isoton = neutron (=)
Isobar = massa atom (=)
Isoelektron = elektron (=)
D.
Bilangan Kuantum
·
Utama (n)
Menyatakan
tingkat energi/nomor kulit terdapatnya elektron.
K(n=1), L(n=2), M(n=3), dst
·
Azimuth (l)
Menyatakan jenis sub kulit tempat terdapatnya elektron, l = 0 s/d
(n-1).
l = 0, sub kulit s
l = 1,
sub kulit p
l = 2,
sub kulit d
l = 3,
sub kulit f
·
Magnetik (m)
Orbital tempat terdapatnya elektron atau biasa disebut kamar
elektron, m = -l s/d +l.
l=0 ; m = 0;
l=1; m=-1, 0, +1
· spin (s)
Arah rotasi elektron dalam orbital, s= +/- 1/2
E. Konfigurasi Elektron
konfigurasi elektron adalah susunan elektron-elektron pada sebuah atom, molekul, atau struktur
fisik lainnya
Ada dua model penulisan komfigurasi elektron
1. model kulit K, L, M, N,...... dst
Langkah-langkahnya :

1. model kulit K, L, M, N,...... dst
Langkah-langkahnya :
- Tentukan terlebih dahulu jumlah elektron yang terdapat pada atom/ion;
- Susunlah elektron tersebut pada kulit K, L, M, N,.....dst berdasarkan urutan tingkat energi-nya;
- Jumlah elektron maksimum yang dapat ditempati pada setiap kulit dinyatakan dengan 2(n)^2 , n adalah nomor kulit. K (2), L (8), M (18), N (32), O (50), P (72).
- Elektron valensi maksimum bernilai 8.
Contoh penulisan konfigurasi elektron dengan model ini dapat adik-adik lihat disini.
2. model sub kulit s, p, d, f
penulisan konfigurasi elektron dengan model ini harus mengacu pada ketentuan berikut,
a. Azas Aufbau
Menurut prinsip Aufbau ini elektron di dalam suatu atom akan berada dalam kondisi yang stabil bila mempunyai energi yang rendah, sedangkan elektron-elektron akan berada pada orbital-orbital yang bergabung membentuk subkulit. Jadi, elektron mempunyai kecenderungan akan menempati subkulit yang tingkat energinya rendah. Subkulit 1s memiliki kingkat energi paling rendah, lalu naik ke sub kulit 2s, 2p, 3s, 3p, sampai terakhir yang paling tinggi 8s. Pastinya elektron yang bisa mengisi subkulit tertentu juga terbatas. Elektron yang mengisi subkulit ini dituliskan dalam bentuk pangkat. sub kulit s maksimal terisi 2 elektron , p terisi 6 elektron, d terisi 10 elektron
, p terisi 6 elektron, d terisi 10 elektron  , dan f terisi 14 elektron
, dan f terisi 14 elektron  ..
..
Menurut prinsip Aufbau ini elektron di dalam suatu atom akan berada dalam kondisi yang stabil bila mempunyai energi yang rendah, sedangkan elektron-elektron akan berada pada orbital-orbital yang bergabung membentuk subkulit. Jadi, elektron mempunyai kecenderungan akan menempati subkulit yang tingkat energinya rendah. Subkulit 1s memiliki kingkat energi paling rendah, lalu naik ke sub kulit 2s, 2p, 3s, 3p, sampai terakhir yang paling tinggi 8s. Pastinya elektron yang bisa mengisi subkulit tertentu juga terbatas. Elektron yang mengisi subkulit ini dituliskan dalam bentuk pangkat. sub kulit s maksimal terisi 2 elektron
Contoh penulisan konfigurasi elektron dengan model ini dapat adik-adik dibawah ini.

b. Aturan Hund
Untuk menyatakan distribusi elektron-elektron pada orbital-orbital dalam suatu subkulit, konfigurasi
elektron dapat dituliskan dalam bentuk diagram orbital. Dua elektron yang menghuni satu orbital
dilambangkan dengan dua anak panah yang berlawanan arah. Jika orbital hanya mengandung satu
elektron, anak panah dituliskan mengarah ke atas.

adalah bila elektron-elektron tersebut tersebar ke semua orbital dengan spin yang sejajar (spin
sama), aturan ini dikenal dengan Aturan Hund.
c. Larangan Pauli
Menurut Pauli tidak ada dua elektron dalam satu atom yang boleh mempunyai keempat bilangan
kuantum yang sama. Orbital yang sama akan mempunyai bilangan kuantum n, l, m yang sama.
Dengan demikian, yang dapat membedakan hanya bilangan kuantum spin (s). Setiap orbital hanya
dapat berisi 2 elektron dengan spin (arah putar) yang berlawanan.
Dengan adanya larangan Pauli ini, maka elektron yang dapat menempati suatu subkulit terbatas
hanya dua kali dari jumlah orbitalnya. Jumlah maksimum elektron adalah sebagai berikut :

Cara menyingkat penulisan konfigurasi elektron
Konfigurasi elektron dari gas mulia dapat dipergunakan untuk menyingkat konfigurasi elektron dari
atom-atom yang mempunyai jumlah elektron (bernomor atom) besar.

perhatiakan cara menyingkat berikut ini :

Penyingkatan ini memberikan kemudahan di dalam menentukan elektron valensi dan diagram
orbital dari suatu atom. Elektron valensi dan diagram orbital ini akan sangat berguna dalam
mempelajari ikatan kimia.
Untuk menyatakan distribusi elektron-elektron pada orbital-orbital dalam suatu subkulit, konfigurasi
elektron dapat dituliskan dalam bentuk diagram orbital. Dua elektron yang menghuni satu orbital
dilambangkan dengan dua anak panah yang berlawanan arah. Jika orbital hanya mengandung satu
elektron, anak panah dituliskan mengarah ke atas.


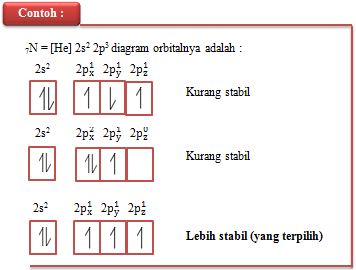
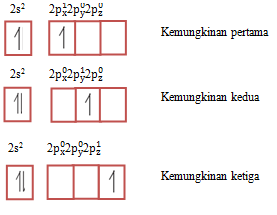
Setiap subkulit (kecuali subkulit s) tersusun atas beberapa orbital dengan energi setingkat, dengan demikian elektron dimungkinkan menempati orbital mana saja. Sebagai contoh : pada atom 5B dengan konfigurasi 1s2 2s2 2p1, sebuah elektron yang terdapat pada subkulit p dapat menempati orbital px, py, atau pz, sebab ketiganya mempunyai tingkat energi yang sama. Ketiga kemungkinan tersebut dapat digambarkan diagram orbitalnya sebagai berikut :
5B = [He] 2s2 2p1 diagram orbitalnya adalah :
Menurut Friedrich Hund (1927), seorang ahli fisika dari Jerman mengemukakan aturan pengisian elektron pada orbital yaitu :
“ orbital-orbital dengan energi yang sama, masing-masing diisi lebih dulu oleh satu elektron arah (spin) yang sama atau setelah semua orbital masing-masing terisi satu elektron kemudian elektron akan memasuki orbital-orbital secara urut dengan arah (spin) berlawanan”
Berdasarkan pendapat Friedrich Hund keadaan yang paling rendah energinya (paling stabil)adalah bila elektron-elektron tersebut tersebar ke semua orbital dengan spin yang sejajar (spin
sama), aturan ini dikenal dengan Aturan Hund.

c. Larangan Pauli
Menurut Pauli tidak ada dua elektron dalam satu atom yang boleh mempunyai keempat bilangan
kuantum yang sama. Orbital yang sama akan mempunyai bilangan kuantum n, l, m yang sama.
Dengan demikian, yang dapat membedakan hanya bilangan kuantum spin (s). Setiap orbital hanya
dapat berisi 2 elektron dengan spin (arah putar) yang berlawanan.
Dengan adanya larangan Pauli ini, maka elektron yang dapat menempati suatu subkulit terbatas
hanya dua kali dari jumlah orbitalnya. Jumlah maksimum elektron adalah sebagai berikut :

Cara menyingkat penulisan konfigurasi elektron
Konfigurasi elektron dari gas mulia dapat dipergunakan untuk menyingkat konfigurasi elektron dari
atom-atom yang mempunyai jumlah elektron (bernomor atom) besar.

perhatiakan cara menyingkat berikut ini :

Penyingkatan ini memberikan kemudahan di dalam menentukan elektron valensi dan diagram
orbital dari suatu atom. Elektron valensi dan diagram orbital ini akan sangat berguna dalam
mempelajari ikatan kimia.
II. SISTEM PERIODIK UNSUR
Sistem periodik unsur disusun berdasarkan pengamatan sifat kimia dan sifat fisis unsur-unsur.
Unsur yang mempunyai kemiripan sifat kimia dan sifat fisis diletakan dalam satu golongan.
Sistem periodik unsur disusun berdasarkan pengamatan sifat kimia dan sifat fisis unsur-unsur.
Unsur yang mempunyai kemiripan sifat kimia dan sifat fisis diletakan dalam satu golongan.

Berdasarkan tabel SIstem Periodik di atas menunjukkan bahwa terdapat keterkaitan antara konfigurasi elektron dengan letak unsur dalam sistem periodik. Untuk mengetahui hubungan tersebut dapat diambil beberapa contoh konfigurasi elektron dari beberapa unsur pada beberapa golongan berikut ini.
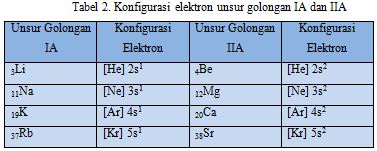
- Unsur Pada Golongan IA dan IIA
Konfigurasi elektron unsur-unsur golongan IA dan IIA dapat dirangkum sebagai berikut :
Berdasarkan Tabel 2 apa yang dapat anda simpulkan ?
- Unsur Pada Golongan IIIA – VIIIA
Bila menggunakan cara yang sama dengan Tabel 2 unsur-unsur golongan IIIA sampai dengan unsur-unsur golongan VIIIA, akan terlihat bahwa elektron valensinya akan menempati subkulit p. Berdasarkan hal tersebut, maka unsur-unsur golongan IIIA sampai dengan golongan VIIIA disebut dengan unsur blok p.
- Unsur pada golongan IB – VIIIB
Unsur-unsur pada golongan IB-VIIIB mempunyai elektron valensi (n-1)dx nsydan dikenal sebagai unsur blok d.
- Unsur pada deret lantanida dan aktinida
Unsur-unsur pada deret Lantanida dan Aktinida memiliki elektron valensi (n-2)fx (n-1)d10 ns2 dan dikenal dengan unsur blok f
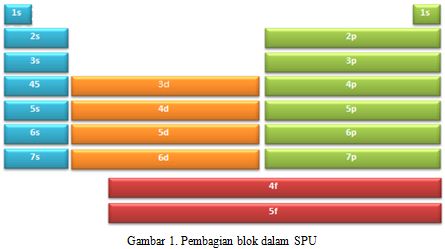
berdasarkan penjelasan di atas maka dapat digambarkan pembagian blok dalam SPU yaitu :
Blok s dan blok p digolongkan sebagai unsur-unsur golongan utama, blok d sebagai unsur transisi, sedangkan blok f sebagai unsur golongan transisi dalam.
Bagaimana adik-adik sudah pahamkah kamu mengenai materi yang dibahas di atas?? Jika belum,
silahkan ulangi lagi mempelajarinya atau adik-adik dapat mempelajari materi SPU lebih lanjut pada video
pembelajarannya disini.
silahkan ulangi lagi mempelajarinya atau adik-adik dapat mempelajari materi SPU lebih lanjut pada video
pembelajarannya disini.














Tidak ada komentar:
Posting Komentar